電負性解釋了
電負性是周期表中所有元素的關鍵特性。它表示為一個數字,該數字將元素吸引電子到其在元素周期表中的位置的能力。在化學鍵中,電負原子越多地獲得額外的電子,產生負電荷,而電負原子較少的電源失去了電子,並獲得正電。
電負性是化學方麵的重要理論概念,可用於合理化分子和固體的穩定性,結構和特性。自從Linus Pauling以來,一位美國化學家在1932年介紹了電負性的概念“分子中原子的力量吸引電子自身”,它在結構化學和固態化學和物理學領域中塑造了許多思維。
鮑林(Pauling)表明,異質極性共價鍵的鍵能由成分原子的均勻鍵能的幾何平均值表示。對於集體係統(例如氣態相)是正確的,但對於具有少量原子的原子尺度係統並不明顯。
電負性是一個基本概念,對於解釋從化學鍵的能量到化學化合物的(ON)穩定性的事物至關重要。它有望與材料的許多物理特性相關 - 從機械(硬度)到電子,光學(例如顏色)。
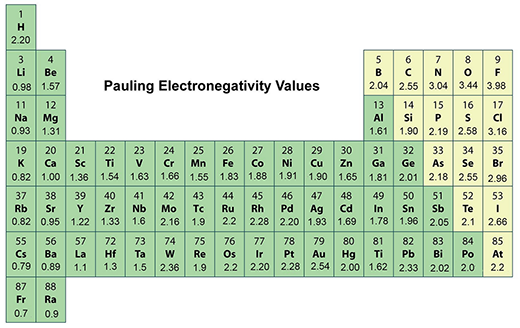
化學家提出了各種電負性的定義和尺度。然而,鮑林的量表是每本化學教科書中都存在的第一個也是最常見的規模。
電負性的定義
電負性定義為原子吸引電子密度的趨勢,即使化學鍵極化。
電負性有許多定義,可以將其大致分為光譜學(這些定義為孤立的原子)或熱化學(表征鍵能和化合物形成的熱量)。最廣泛使用的是熱化學保羅的秤,電負重性具有EV的單位1/2。
電負性是一個派生的數量,因此不可直接測量。它是相對於氫在Pauling量表上的值為2.20的相對。
電負性的例子
在氧氣中(O2)分子,兩個原子具有相同的電負性。共價鍵中的電子在兩個氧原子之間平均共享。
氯原子具有比氫原子更高的電負性,因此鍵合電子將比HCl分子中的H更接近Cl。
如何確定電負性
保林使用某些化學鍵的能量從熱化學中推導了他的電負性值。他提出了最簡單的公式來計算由於原子之間的電負性差異而計算鍵的穩定性。後來經曆了鮑林量表的預測準確性相當低。
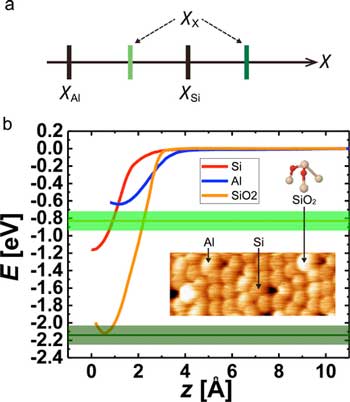
僅通過實驗來測定表麵原子的電負性(來源)。(a)Si,al和未知X原子的電負性的大小關係。(b)在Si(紅色),Al(藍色)Adatoms和Sio上獲得的短距離E(Z)曲線2(橙色)分別。SIO鍵能的預期值2由Al尖端獲取的透明和深色綠色線和其誤差帶表示。插圖顯示了SI,Al Adatoms和Sio的典型地形圖像2在Si(111) - (7x7)表麵上。Sio的球模型2代表奶油中的si,紅色代表o。(經美國化學學會許可轉載)
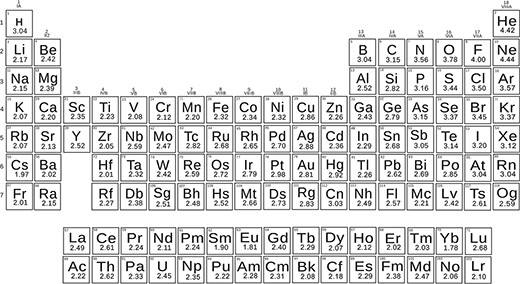
最近,科學家修改了鮑林的公式,並重新定義了元素的電負重性。這導致創建了新的電負性量表(發表在自然通訊:元素的熱化學電負重性)。
該論文的對應作者Artem R. Organov教授解釋說:“這一切始於我們決定在壓力下計算鮑林的電負重性。一旦您了解了在壓力下的電負重性如何變化。我們使用鮑林的定義來計算正常條件下的電負性。我們驚訝地發現他的量表與顯著離子分子的理論或實驗鍵能不匹配。”
他繼續說:“此外,許多化學文獻中的許多出版物都提到了這種矛盾,但沒有一個提供一致的解決方案。我意識到根本原因是保林將分子的離子穩定性視為添加效應。如果我們認為這是一種乘法效果,將消除許多缺點。”
使用新的配方和化學鍵的實驗能,科學家確定了所有元素的電負重性。他們獲得了一個美麗的量表,可用於電負性的小和大差異。
新量表將電負性用作無量綱的數量,這是非常實用的,並且可以準確地再現分子的能量和化學反應。
新的熱化學電膠質值的周期表。
大多數和最少的電負元素
元素周期表最多的電負元素是氟(在彩林量表上為3.98,在元素周期表中右上方)。最低電負性元件是剖宮產(在彩林尺度上為0.79,從周期表中的底部留在第二行)。
請注意,較舊的文本在0.7處列出了最少的電負格,但剖宮產的值已在實驗上修改為0.79值。沒有用於法蘭克的實驗數據,但其電離能量高於剖腹產,因此預計frandium的電源稍微稍微更高。
電負性周期性表趨勢
當您從元素周期表中的一個周期從左向右移動時,電負性通常會增加。當您向下移動一組時,它會減少。
這意味著在元素周期表的右上角發現了最大的電負元素,而電負性元件的最低元件位於左下方。
電負性和電離能遵循相同的周期表趨勢。電離能較低的元件往往具有低電負重性。這些原子的核不會對電子施加強烈的吸引。同樣,具有高電離能的元素傾向於具有較高的電負性值。原子核對電子施加了強烈的吸引力。